 |
Fluoreszenz
Fluoreszenz ist die Fähigkeit bestimmter chemischer Substanzen, kurzwelliges Licht aufzunehmen und scheinbar gleichzeitig als langwelliges Licht wieder zurückzuwerfen. Dabei scheint es sich auf den ersten Blick nur um eine simple Filterung oder Reflexion zu handeln, etwa wie bei den Glanzlichtern hochpolierter Oberflächen.
In Wahrheit aber werden unsichtbare, kurzwellige Lichtanteile etwa des Tageslichtes mit hoher Energie (z.B. UV-Licht oder Röntgenstrahlung) zunächst absorbiert, dann mehr oder weniger lang gespeichert, regen im weiteren Verlauf Elektronen zu Quantensprüngen in ein höheres Energieschema (Band) an und senden schließlich beim Zurückkehren dieser Elektronen in ihr vorheriges, tieferliegende Band neue, energieärmere Lichtquanten größerer Wellenlänge im sichtbaren Bereich aus.
Man könnte also gewissermaßen von einer Art "optischem Frequenzteiler" sprechen.
Wie schon gesagt, erfüllen auch manche fluoridhaltigen Mineralien sowie Zinksulfid und Zinksilikate diese Aufgabe und finden in Verbindung mit verschiedenen Zusätzen z.B. bei der Herstellung spezieller Leuchtschirme für Oszilloskope, Radargeräte, Fernsehbildröhren, Röntgengeräte und als lange nachleuchtende Farbe für Zifferblätter und ähnliche Dinge Verwendung.
Man spricht in diesem Falle auch von Phosphoreszenz
Eine weit interessantere Stoffklasse sind aber fluoreszierende, organische Farbstoffe, deren älteste Vertreter das orange- bis gelbgrünliche FLUORESCEIN und das hieraus abgeleitete gelbrot bis rote EOSIN sind.
 |
Deutlich im Bild erkennbar ist die eher nur schwache Fluoreszenz von Eosin
im Vergleich zum kräftig grün leuchtenden Fluoreszein
Folgende Grafik zeigt uns die chemische Struktur beider Farbstoffe:
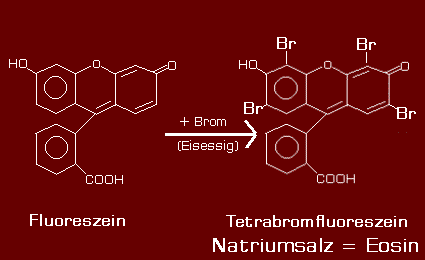 |
| Synthese von
Eosin aus Fluoreszein mittels Bromierung in Eisessig |
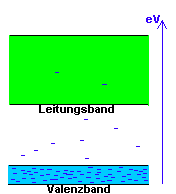
Die Fluoreszenz selbst und die Schalteigenschaften von S-13 kann man analog zu den Halbleitern leicht mit Hilfe eines modifizierten "Bändermodells" erklären.
 |
 |
 |
| Isolator | Fluoreszenzfarbstoff | S-13 |
Während bei Isolatoren, Leitern und Halbleitern sich alles um freie, bewegliche Ladungen im sogenannten Leitungsband dreht, spricht man bei der Photonik nur von Grundzuständen und angeregten Zuständen, welchen man die entsprechenden Energiebänder
S0 und S1
zuordnet.- Diese Bänder haben also nichts mit elektrischer Leitfähigkeit zu tun, sondern beschreiben nur das jeweilige energetische Potential eines Moleküls. Der Wechsel zwischen S0 und S1 wird dabei durch Energieaufnahme oder Abgabe bestimmt und entscheidet damit auch über Fluoreszenz oder Nichtfluoreszenz.
 |
 |
 |
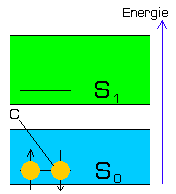
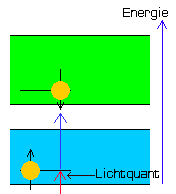
| Grundzustand ( keine Fluoreszenz ) |
Anregung ( Lichtabsorption ) |
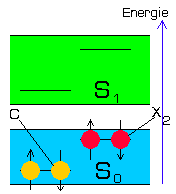
Emission ( Fluoreszenz ) |
Im Grundzustand befinden sich zwei Elektronen eines außen liegenden Atomorbitals
des Chromophors C (Gelbe Symbole) im Energieband S0.
Dabei symbolisieren die Kugeln und Pfeile der Grafiken jeweils 2 Elektronen mit entgegengesetztem Spin (Pfeile), welche zusammen ein voll besetztes Orbital bilden.
Beim Bestrahlen mit energiereichem, kurzwelligem Licht (z.B. Ultraviolett) dringen einzelne Lichtquanten in ein solches Orbital ein und werden als Energie absorbiert.
Dadurch wird ein Elektron aus S0 in das höhere Energieband S1 gehoben (Anregung) und fällt anschließend nach einer für den Farbstoff spezifischen Zeitkonstante wieder in das alte Energieband zurück.
Dabei wird die verminderte Restenergie des ursprünglichen Lichtquants wieder freigesetzt und verlässt das System als sichtbarer Lichtblitz mit einer tieferen Frequenz (Emission). Der Vorgang findet natürlich in vielen Orbitalen gleichzeitig und immer wieder aufs Neue statt, so dass die resultierende Fluoreszenz während der gesamten Bestrahlungsdauer als kontinuierliches Leuchten beobachtet werden kann.
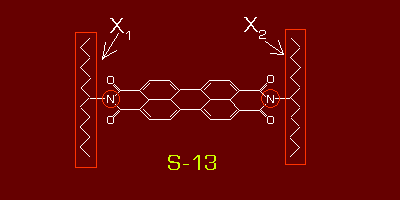
Im Leistungsfluoreszenzfarbstoff S-13 werden nun zunächst die Kohlenstoffketten an den beiden Stickstoffatomen im
S-13 Grundgerüst jeweils durch spezielle Substituenten X1 und X2 ersetzt.
X2 ist dabei so ausgewählt, dass er sich energetisch zwar noch im S0 Band befindet, jedoch deutlich über dem Energieniveau des Chromophors C liegt.
 |
In den nachfolgenden Grafiken spielen daher ebenfalls nur die äußeren Elektronen der Stickstoffatome eine Rolle, die im S-13 mit einem
Substituenten X2 (Rote Symbole)
versehen wurden, dessen höchstes besetztes Molekülband energetisch über dem des
Chromophors C(Gelbe Symbole)
selbst liegt. Dabei symbolisieren die Kugeln und Pfeile der Grafiken jeweils 2 Elektronen mit entgegengesetztem Spin (Pfeile), welche ein voll besetztes Atomorbital bilden.
Der Substituent X1 (Polymermatrix) dient dagegen nur als Träger zur genauen Fixierung der einzelnen Chromophormoleküle in einem bestimmten funktionellen Array
und spielt somit energetisch keine Rolle.
Er wurde in den folgenden Grafiken daher nicht mehr berücksichtigt.
 |
 |
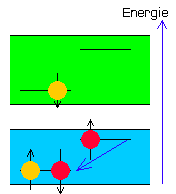 |
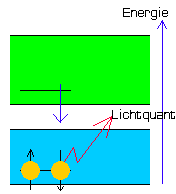
| Grundzustand S-13 ( keine Fluoreszenz ) |
Anregung S-13 ( Lichtabsorption ) |
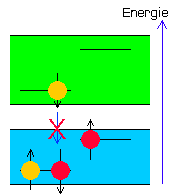
Transfer S-13 ( keine Fluoreszenz ) |
Im Grundzustand zeigt der reine Chromophor-Substituenten-Komplex keine Fluoreszenz. Durch Bestrahlung mit unsichtbarem UV-Licht höherer Frequenz (Lichtabsorption) springt ein einzelnes Elektron des Chromophors in das S1 Band und das Molekül befindet sich im angeregten Zustand (Anregung). Beim Zurückfallen des gesprungenen Elektrons ins S0 Band würde nun wieder Energie frei und als Licht einer nun niedrigeren Frequenz abgestrahlt.
Dies entspräche der sichtbaren, grünen Fluoreszenz des Fluoreszeins oder Eosins. Danach wäre das Chromophor wieder im Grundzustand und damit erneut in der Lage, Lichtquanten höherer Frequenz zu absorbieren.
Der geschilderte Vorgang würde sich dann solange kontinuierlich wiederholen, wie das Chromophor mit UV-Licht bestrahlt wird.
Ich sage bewusst: "wäre" und "würde", denn dies alles gilt nur bei normalen Fluoreszenzfarbstoffen ohne den speziellen Substituenten X2 wie im S-13.
Im Falle des S-13 liegt die Sache anders:
Der Substituent X2 bewirkt, da er energetisch höher liegt als das Chromophor und sein Zustand damit auch unstabiler ist, den Sprung eines seiner beiden Elektronen mit passendem Spin nach unten, also in das zu dieser Zeit nur noch halb besetzte Atomorbital des Chromophors (Transfer). Dadurch wird dieses erneut aufgefüllt und kann nun wiederum das eigene Elektron aus S1 nicht mehr aufnehmen!
Das heisst im Klartext:
Selbst nach Beenden der UV-Bestrahlung erfolgt kein Rücksprung und damit auch keine Aussendung von Licht mehr! Die Fluoreszenz ist also erst einmal dauerhaft blockiert. Das Chromophor befindet sich in Bereitschaft.
 |
 |
 |
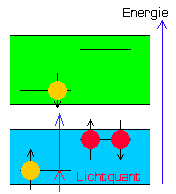
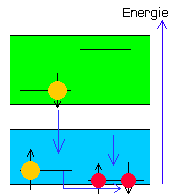
| Bereitschaft S-13 ( keine Fluoreszenz ) |
Reset S-13 ( keine Fluoreszenz ) |
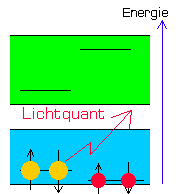
Emission S-13 ( Fluoreszenz ) |
Durch einen bisher noch nicht veröffentlichten Trick (Reset) kann nun das Energieniveau des Substituenten künstlich bis unter das des Chromophors abgesenkt werden.
Dadurch springt das blockierende Elektron im Chromophor wieder auf seinen ursprünglichen Platz im Substituenten zurück und auch das im S1-Band befindliche Chromophorelektron kann nun wieder unter Aussendung eines Lichtquants recombinieren.
Das Molekül fluoresziert (Emission).
Die geschilderten Zustände könnten also leicht zur Realisierung der Schaltcharakteristik eines optischen Transistors verwendet werden.